022年4月6日,美国旧金山和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售用于治疗肿瘤、代谢疾病、自身免疫等重大疾病的创新药物的生物制药公司,今日宣布达伯坦®(佩米替尼片,pemigatinib)在中国获得国家药品监督管理局(NMPA)批准用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。
来自:NMPA 官网
pemigatinib 由 Incyte 公司开发,于 2020 年 4 月在美国获批上市,商品名为 Pemazyre®。
信达生物在 2018 年 12 月与 Incyte 达成战略合作,获得了该公司包括 Pemigatinib 在内的 3 款药物在中国内地及港澳台地区的临床开发和商业化权益,而 Incyte 公司则获得信达生物的 4000 万美元首付款、首次递交 IND 申请后的第二笔 2000 万美元付款、潜在开发及监管里程碑款最高 1.29 亿美元和潜在商业里程碑 2.025 亿美元。合作中的另外两款分别为 itacitinib(JAK1 抑制剂)和 parsaclisib(PI3Kδ 抑制剂)。
该适应症的获批主要基于两项临床研究。一项为在海外既往经过至少一线系统性治疗失败的、伴FGFR2融合或重排的、手术不可切除的局部晚期、复发性或转移性胆管癌受试者中评价佩米替尼的疗效和安全性的II期、开放性、单臂、多中心的研究(FIGHT202研究,NCT02924376)。另一项是在中国进行的多中心、开放性、单臂试验(研究代号:CIBI375A201, NCT04256980),目的为评价佩米替尼在中国同类胆管癌受试者的疗效和安全性。两项研究的主要终点都是基于独立影像委员会(IRRC)根据实体瘤评价标准V1.1评价的客观缓解率(ORR)。
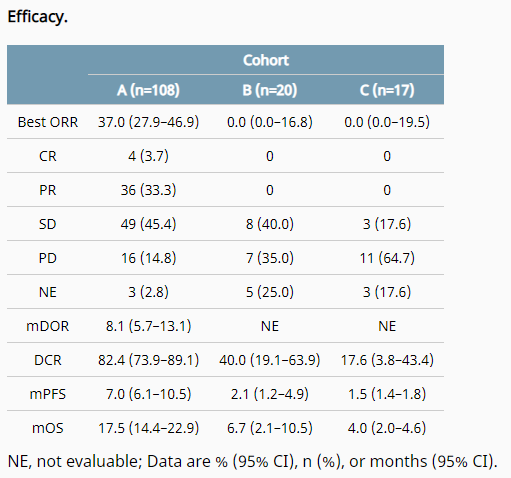
在 FIGHT- 202 研究中,共入组 108 例胆管癌受试者,接受 pemigatinib 13.5 mg 口服治疗,其中基于 IRRC 评估的已确认的 ORR 为 37%(95% CI:27.94%,46.86%),包括 4 例完全缓解(3.7%)和 36 例部分缓解(33.3%),中位缓解持续时间(DOR)为 8.08 个月(95% CI:5.65,13.14),中位无进展生存期(PFS)为 7.03 个月(95% CI:6.08,10.48),pemigatinib 可引起持久的肿瘤缓解,中位总生存期(OS)达 17.48 个月(95% CI:14.42,22.93)。
DOI: 10.1200/JCO.2021.39.15_suppl.4086
Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 4086-4086.
安全性方面,pemigatinib 具有良好的耐受性。在 147 例纳入安全性分析的受试者中,高磷酸血症为最常见的不良反应,发生率为 58.5%。有 68.7% 的受试者发生 3 级或 3 级以上的不良反应,最常报告的为低磷酸血症(14.3%),其他包括关节痛和口腔黏膜炎(各 6.1%)、腹痛、疲乏和低钠血症(均为 5.4%),其他还有掌跖红肿综合征和低血压,发生率分别为 4.8% 和 4.1%。
国内桥接试验 INCB 54828-202 研究的数据也已经在 2021 ESMO 上以壁报形式发布。该项试验分成两部分,第一部分为在中国人群中的 PK 研究,纳入 3 例胆管癌受试者;第二部分则纳入 31 例 FGFR2 基因融合或重排阳性的胆管癌受试者,临床主要终点为第二部分受试者由 IRRC 依据 RECIST v1.1 评估的 ORR。
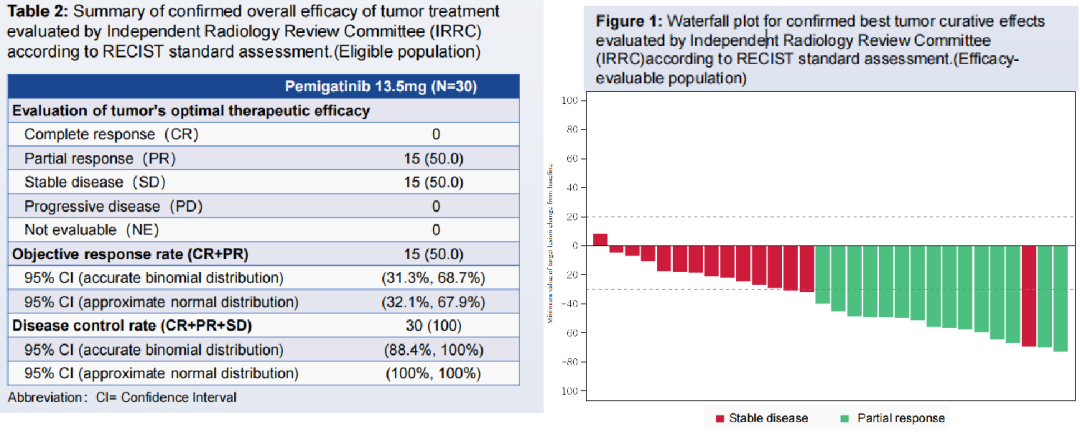
在 30 例疗效可评价人群中,15 例患者达到 IRRC 确认的疾病缓解,主要终点指标 ORR 达到 50% (95%CI: 31.3%,68.7%)。中位随访 5.13 个月时,12 例患者仍处于病情缓解中,中位缓解持续时间(DOR)尚未达到(95%CI: 3.4,NR),至数据截止日期,中位无进展生存期(PFS)数据尚未成熟,仅有 6 例发生 PFS 事件,疾病控制率(DCR)为 100% (95%CI: 88.4%,100%)。
胆道癌(BTC)是发生在胆管和胆囊中的一种罕见的侵袭性癌症。其中胆管癌起源于胆管上皮细胞,是第二常见的原发于肝脏的恶性肿瘤。乙肝病毒及其他肝脏寄生虫的感染导致其在亚洲地区发病率较高。
手术是目前唯一具有治愈潜力的治疗方式,但是大部分胆管癌患者在初诊时即为不可切除性肿瘤或存在转移,失去了手术根治的机会。这类患者的一线标准治疗为顺铂联合吉西他滨,但中位总生存期(OS)约 11.7 个月,治疗效果有限;而一线治疗失败后的患者推荐积极症状控制+mFOLFOX 方案进行治疗, 中位 OS 仅为 5-6 个月,亟待可以提高患者生活质量和疗效的药物出现。
从靶向药角度来看,FDA 目前仅批准了 3 款胆管癌靶向药。这三款胆管癌治疗药物都在 2020 年及 2021 年才刚刚获批,其中两款为 FGFR 抑制剂,信达/Incyte 的 Pemigatinib 和联拓/BrigeBio 的 Infigratinib;一款为 IDH1 抑制剂艾伏尼布,由 Agios Pharmaceuticals 开发,基石药业引进。
从免疫疗法角度看,这一癌种上也是挫折不断,2021 年默克的 PD-L1/TGFβ 双特异性融合蛋白 M7824 正是在胆道癌方面惨遭一线二线二连败。首个取得积极突破的是阿斯利康的 PD-L1 度伐利尤单抗(Imfinzi),预计今年在这项新适应症申报后,才能实现免疫疗法在胆道癌领域的破零。